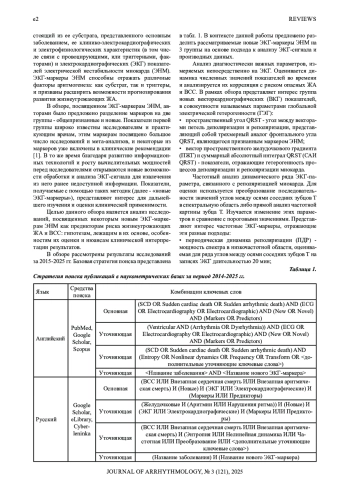
Среди исследований проблемы ЭКГ-стратификации риска внезапной сердечной смерти и жизнеугрожающих желудочковых аритмий представляют интерес новые подходы к анализу ЭКГ-данных и маркеров электрической нестабильности миокарда на их основе. В частности, заслуживают внимания показатели, получаемые с помощью векторного, частотного и нелинейного анализа ЭКГ-данных, продемонстрировавшие ценность в качестве предикторов опасных желудочковых аритмий и внезапной сердечной смерти.
Идентификаторы и классификаторы
Внезапная сердечная смерть (ВСС) - одна из важнейших проблем современного здравоохранения. Согласно современным представлениям, наиболее частой ее причиной являются жизнеугрожающие желудочковые аритмии (ЖА), к которым относятся устойчивая желудочковая тахикардия (ЖТ) и фибрилляция желудочков (ФЖ).
Список литературы
1. Степанов ДА, Татаринова АА. ЭКГ-стратификация риска внезапной сердечной смерти и жизнеугрожающих желудочковых аритмий. Вестник аритмологии. 2024;31(1): 77-91.
Stepanov DA, Tatarinova AA. ECG-based risk stratification of sudden cardiac death and life-threatening ventricular arrhythmias. Journal of Arrhythmology. 2024;31(1): 77-91. (In Russ.). DOI: 10.35336/VA-1213
2. Nonlinear Biomedical Signal Processing / еd. by Metin Akay. Vol. 2. Dynamic Analysis and Modelling. New York: IEEE; 2001.
3. Немирко АП, Манило ЛА, Калиниченко АН. Математический анализ биомедицинских сигналов и данных. Москва 2017.
Nemirko AP, Manilo LA, Kalinichenko AN. Mathematical analysis of biomedical signals and data. Moscow 2017. (In Russ.) 978-5- 9221-1720-3. ISBN: 978-5-9221-1720-3
4. Wilson FN, Macleod AG, Barker PS, et al. The determination and the significance of the areas of the ventricular deflections of the electrocardiogram. Am Heart J. 1934;10: 46-61.
5. Tereshchenko LG, Cheng A, Fetics BJ, et al. Ventricular arrhythmia is predicted by sum absolute QRST integral but not by QRS width. J Electrocardiol. 2010;43(6): 548-52. DOI: 10.1016/j.jelectrocard.2010.07.013
6. Tereshchenko LG, Cheng A, Fetics BJ, et al. A new electrocardiogram marker to identify patients at low risk for ventricular tachyarrhythmias: sum magnitude of the absolute QRST integral. J Electrocardiol. 2011;44: 208-16. DOI: 10.1016/j.jelectrocard.2010.08.012
7. Tereshchenko LG, McNitt S, Han L, et al. ECG marker of adverse electrical remodeling post-myocardial infarction predicts outcomes in MADIT II study. PLoS One. 2012;7(12): e51812. 10.1371/journal. pone.0051812. DOI: 10.1371/journal.pone.0051812
8. Oehler A, Feldman T, Henrikson CA, et al. QRS-T angle: a review. Ann Noninvasive Electrocardiol. 2014;19: 534-42. DOI: 10.1111/anec.12206
9. Perez-Alday EA, Bender A, German D, et al. Dynamic predictive aCCC Curacy of electrocardiographic biomarkers of sudden cardiac death within a survival framework: The Atherosclerosis Risk in Communities (ARIC) study. BMC Cardiovasc Disord. 2019;19(1): 255. DOI: 10.1186/s12872-019-1234-9
10. Waks JW, Sitlani CM, Soliman EZ, et al. Global Electric Heterogeneity risk score for prediction of sudden cardiac death in the general population: the Atherosclerosis Risk in Communities (ARIC) and Cardiovascular Health (CHS) Studies. Circulation. 2016;133(23): 2222-34. DOI: 10.1161/CIRCULATIONAHA.116.021306
11. Waks JW, Hamilton C, Das S, et al. Improving sudden cardiac death risk stratification by evaluating electro-cardiographic measures of global electrical heterogeneity and clinical outcomes among patients with implantable cardioverter-defibrillators: rationale and design for a retrospective, multicenter, cohort study. J Interv Card Electrophysiol. 2018;52(1): 77-89. DOI: 10.1007/s10840-018-0342-2
12. Waks JW, Haq KT, Tompkins C, et al.Competing risks in patients with primary prevention implantable cardioverter-defibrillators: Global Electrical Heterogeneity and Clinical Outcomes study. Heart Rhythm. 2021;18(6): 977-86. DOI: 10.1016/j.hrthm.2021.03.006
13. Rizas KD, Nieminen T, Barthel P et al. Sympathetic activity-associated periodic repolarization dynamics predict mortality following myocardial infarction. J Clin Invest. 2014;124(4): 1770-80. DOI: 10.1172/JCI70085 EDN: SRJIEN
14. Rizas KD, McNitt S, Hamm W, et al. Prediction of sudden and non-sudden cardiac death in post-infarction patients with reduced left ventricular ejection fraction by periodic repolarization dynamics: MADIT-II substudy. Eur Heart J. 2017;38(27): 2110-8. DOI: 10.1093/eurheartj/ehx161 EDN: YIAFVE
15. Palacios S, Cygankiewicz I, Bayés de Luna A, et al. Periodic repolarization dynamics as predictor of risk for sudden cardiac death in chronic heart failure patients. Sci Rep. 2021;11(1): 20546. DOI: 10.1038/s41598-021-99861-1 EDN: XFEYXB
16. Burattini L, Giuliani C. T-wave frequency content evaluation in healthy subjects and patients affected by myocardial infarction. In: Signal Processing: New Research (ed. Naik GR). NY 2013: 79-93.
17. Langner PH, Jr., Geselowitz DB, Mansure FT, et al. High-frequency components in the electrocardiograms of normal subjects and of patients with coronary heart disease. Am Heart J. 1961;62(6): 746-55. DOI: 10.1016/0002-8703(61)90661-5
18. Giuliani C, Agostinelli A, Fioretti S, et al. Abnormal repolarization in the acute myocardial infarction patients: a frequency-based characterization. Open Biomed Eng J. 2014;8: 42-51. DOI: 10.2174/1874120701408010042
19. Giuliani C, Swenne CA, Man S, et al. Predictive power of f99 repolarization index for the oCCC Currence of ventricular arrhythmias. Ann Noninvasive Electrocardiol. 2016;21(2): 152-60. DOI: 10.1111/anec.12274
20. Pincus SM. Approximate entropy as a measure of system complexity. Proc Natl Acad Sci U S A. 1991;88(6): 2297-301. DOI: 10.1073/pnas.88.6.2297
21. Pincus SM. Approximate entropy in cardiology. Herzschr Elektrophys. 2000;11: 139-50. DOI: 10.1007/s003990070033
22. Richman JS., Moorman JR. Physiological time-series analysis using approximate entropy and sample entropy. Am J Physiol Heart Circ Physiol. 2000;278(6): 2039-49. DOI: 10.1152/ajpheart.2000.278.6.H2039
23. Costa M, Goldberger AL, Peng CK. Multiscale entropy analysis of complex physiologic time series. Phys Rev Lett. 2002;89(6): 068102. DOI: 10.1103/Phys-RevLett.89.068102
24. Kobayashi M, Musha T. 1/f fluctuation of heartbeat period. IEEE Trans Biomed Eng. 1982;29(6): 456-7. DOI: 10.1109/TBME.1982.324972
25. Goldberger AL. Fractal electrodynamics of the heartbeat. Ann N Y Acad Sci. 1990;591: 402-9. DOI: 10.1111/j.1749-6632.1990.tb15104.x
26. Peng CK, Havlin S, Stanley HE, et al. Quantification of scaling exponents and crossover phenomena in nonstationary heartbeat time series. Chaos. 1995;5(1): 82-7. DOI: 10.1063/1.166141
27. Huikuri HV, Mäkikallio TH, Peng CK, et al. Fractal correlation properties of R-R interval dynamics and mortality in patients with depressed left ventricular function after an acute myocardial infarction. Circulation. 2000;101(1): 47-53. DOI: 10.1161/01.cir.101.1.47
28. Mäkikallio TH, Huikuri HV, Mäkikallio A, et al. Prediction of sudden cardiac death by fractal analysis of heart rate variability in elderly subjects. J Am Coll Cardiol. 2001;37(5): 1395-402. DOI: 10.1016/s0735-1097(01)01171-8 EDN: BDMIEB
29. Rohila A, Sharma A. Detection of sudden cardiac death by a comparative study of heart rate variability in normal and abnormal heart conditions. J Appl Biomed. 2020;40(3): 1-15. DOI: 10.1016/j.bbe.2020.06.003
30. Yan SP, Song X, Wei L, et al. Performance of heart rate adjusted heart rate variability for risk stratification of sudden cardiac death. BMC Cardiovasc Disord. 2023;23(1): 144. DOI: 10.1186/s12872-023-03184-0
31. Hernesniemi JA, Pukkila T, Molkkari M, et al. Prediction of sudden cardiac death with ultra-short-term heart rate fluctuations. JACCC C Clin Electrophysiol. 2024;10(9): 2010-20. DOI: 10.1016/j.jacep.2024.04.018 EDN: YQXJYW
32. Ebrahimzadeh E, Pooyan M, Bijar A. A novel approach to predict sudden cardiac death (SCD) using non-linear and time-frequency analyses from HRV signals. PLoS One. 2014;9(2): e81896. DOI: 10.1371/journal.pone.0081896 EDN: YBVJJQ
33. Ebrahimzadeh E, Fayaz F, Ahmadi F, et al. Linear and nonlinear analyses for detection of sudden cardiac death (SCD) using ECG and HRV signals. Trends Res. 2018;1: 1-8. DOI: 10.15761/tr.1000105
34. Ebrahimzadeh E, Foroutan A, Shams M, et al. An optimal strategy for prediction of sudden cardiacdeath through a pioneering feature-selection approach from HRV signal.Comput Methods Programs Biomed. 2019;169: 19-36. DOI: 10.1016/j.cmpb.2018.12.001
35. Shi M, He H, Geng W, et al. Early detection of sudden cardiac death by using ensemble empirical mode decomposition-based entropy and classical linear features from heart rate variability signals. Front Physiol. 2020;11: 118. DOI: 10.3389/fphys.2020.00118 EDN: CGRYHH
36. Yang J, Sun Z, Zhu W, et al.Intelligent prediction of sudden cardiac death based on multi-domain feature fusion of heart rate variability signals. EURASIP J Adv Signal Process. 2023;32: 1-15. DOI: 10.1186/s13634-023-00992-6
37. DeMazumder D, Limpitikul WB, Dorante M, et al. Entropy of cardiac repolarization predicts ventricular arrhythmias and mortality in patients receiving an implantable cardioverter-defibrillator for primary prevention of sudden death. Europace. 2016;18(12): 1818-28. DOI: 10.1093/europace/euv399
38. Cheng A, Dalal D, Butcher B, et al. Prospective Observational Study of Implantable Cardioverter-Defibrillators in primary prevention of sudden cardiac death: study design and cohort description. J Am Heart Assoc. 2013;2(1): e000083. DOI: 10.1161/JAHA.112.000083
39. Levy WC, Mozaffarian D, Linker DT, et al. The Seattle Heart Failure Model: prediction of survival in heart failure. Circulation. 2006;113: 1424-33. DOI: 10.1161/CIRCULATIONAHA.105.584102
40. DeMazumder D, Lake DE, Cheng A, et al. Dynamic analysis of cardiac rhythms for discriminating atrial fibrillation from lethal ventricular arrhythmias. Circ Arrhythm Electrophysiol. 2013;6: 555-61. DOI: 10.1161/CIRCEP.113.000034
41. Perkiomaki JS, Couderc JP, Daubert JP, et al. Temporal complexity of repolarization and mortality in patients with implantable cardioverter defibrillators. Pacing Clin Electrophysiol. 2003;26: 1931-6. DOI: 10.1046/j.1460-9592.2003.00298.x
42. Murugappan M, Murugesan L, Jerritta S, et al. Sudden cardiac arrest (SCA) prediction using ECG morphological features. Arab J Sci Eng. 2020;46(2): 947-61. DOI: 10.1007/s13369-020-04765-3
43. Buchman TG. Nonlinear dynamics, complex systems, and the pathobiology of critical illness. Curr Opin Crit Care. 2004;10(5): 378-82. DOI: 10.1097/01.CCCCx.0000139369.65817.b6
44. Ivanov PCh, Rosenblum MG, Peng CK, et al. Scaling and universality in heart rate variability distributions. Physica A. 1998;249: 587-93. DOI: 10.1016/s0378-4371(97)00522-0
45. Rigoli LM, Lorenz T, Coey C, et al. Co-actors exhibit similarity in their structure of behavioural variation that remains stable across range of naturalistic activities. Sci Rep. 2020;10(1): 6308. DOI: 10.1038/s41598-020-63056-x EDN: EJOBYF
46. The Colors of Noise. Wikimedia Commons, 2015. ACCC Cessed 2025-08-02. Available from https://commons.wikimedia.org/wiki/File:The_Colors_of_Noise.png.
Выпуск
Другие статьи выпуска
В статье представлены современные методы анестезиологического пособия, используемые в ходе выполнения таких интервенционных и хирургических вмешательств как имплантация кардиостимуляторов, устройств сердечной ресинхронизирующей терапии, кардиовертеров-дефибрилляторов и проведения катетерной аблации. Обсуждаются преимущества, недостатки и проблемные вопросы анестезии в зависимости от типа вмешательства и состояния пациента. На основании проанализированных данных делается вывод о том, что анестезия в ходе вмешательств у пациентов аритмологического профиля является общемировой практикой и подчеркивается положительное влияние методов анестезии на качество и безопасность выполняемых процедур.
Статья посвящена анализу выбора устройства для сердечной ресинхронизирующей терапии, опираясь на стратификацию риска внезапной сердечной смерти. Рассматриваются возможные методы диагностики и клинико-анамнестические данные, а также их роль в прогнозировании аритмогенных событий и принятии решений об имплантации. Обсуждаются различия в подходах к имплантации у пациентов с ишемической и неишемической кардиомиопатией, значимость комбинированной оценки риска и применение прогностических моделей. Рассматриваются нерешенные вопросы оптимального отбора пациентов, сроков оценки эффективности СРТ и возможных стратегий имплантации устройств с учетом экономических и клинических факторов.
Представлен впервые зарегистрированный на территории Республики Казахстан клинический случай ребенка с редким митохондриальным заболеванием - синдромом Кернса-Сейра, у которого в связи с развитием полной атриовентрикулярной блокады был имплантирован электрокардиостимулятор. Обсуждаются вопросы диагностики и тактики ведения.
Цель. Оценить влияние предсердной стимуляции (atrial pacing, AP) на развитие предсердных экстрасистол (ПЭС) и эпизодов наджелудочковой тахикардии у пациентов с двухкамерными электрокардиостимуляторами (ЭКС).
Материал и методы исследования. В исследование включены 97 пациентов, перенесших имплантацию двухкамерных ЭКС. Проведен анализ 169 контрольных осмотров в период от 1 до 20 месяцев после операции. Оценивались показатели предсердной стимуляции, групповые ПЭС и эпизоды наджелудочковой тахикардии. Исходные данные обрабатывались в Microsoft Excel и Access, статистический анализ проведён в Jupyter Notebook (Python 3. x).
Результаты. Установлена умеренная положительная корреляция между ПЭС и эпизодами наджелудочковой тахикардии (ρ =0,623, p<0,001). В группе AP ≥ 91% отмечено снижение частоты наджелудочковой тахикардии (предсердной тахикардии / фибрилляции предсердий) продолжительностью более 24 часов (p=0,060). Логистическая регрессия показала значимое снижение риска наджелудочковой тахикардии продолжительностью более 24 часов при AP 51-90% (отношение рисков 0,31, p=0,002).
Заключение. Высокий уровень предсердной стимуляции может снижать риск длительных эпизодов наджелудочковой тахикардии, однако влияние предсердной стимуляции ЭКС на эпизоды ПЭС не достигло статистической значимости.
Цель. Сравнить непосредственные и отдаленные результаты катетерного лечения фибрилляции предсердий (ФП) после криобаллонной аблации (КБА) легочных вен (ЛВ) с использованием криобаллона второго поколения и радиочастотной аблации (РЧА) ЛВ вен на навигационной системе с катетером c датчиком давления «катетерткань» c использованием модуля Ablation Index (AI).
Материал и методы исследования. В исследование были включены 199 пациентов, направленных на процедуру катетерной изоляции ЛВ в период 2018-2021 гг. Пациенты были распределены на две группы: исследуемая группа - 110 пациентов, у которых изоляция ЛВ достигалась путем РЧА с помощью катетера с модулем AI; контрольная группа - 89 пациентов, подвергшиеся КБА ЛВ криобаллоном второго поколения. Период наблюдения был ограничен 36 месяцами, средний период наблюдения составил 27,9±14,2 месяцев.
Результаты. Трехлетняя эффективность КБА и РЧА ЛВ является сопоставимой (свобода от предсердных тахиаритмий в группе РЧА - 0,61±0,05, в группе КБА - 0,62±0,05, (Log-Rank test, p = 0,896)) при сходной частоте и структуре осложнений (3,6% (4) vs. 4,5 (4), p=0,759). Частота рецидивов ФП в «слепом» периоде достоверно ниже в группе РЧА (1,8% (2) vs. 9,0% (8) в группе РЧА, p=0,045). Длительность оперативного вмешательства значимо меньше в группе криоаблации (РЧА 92,7±20,9 мин, КБА 83,9±19,6 мин, p=0,005). Потребность в повторном оперативном вмешательстве сопоставима для обеих групп (РЧА 21,8% (n=24), КБА 30,3% (n=27), p=0,171).
Заключение. Сравнительный анализ трехлетней эффективности радиочастотной антральной изоляции легочных вен катетером с использованием модуля AI продемонстрировал сопоставимость результатов с аблацией криобаллоном второго поколения. При этом в «слепом» периоде наблюдения группа РЧА характеризовалась статистически значимым снижением частоты рецидивов предсердной тахиаритмии по сравнению с группой КБА.
Цель. Изучить значение индекса аблации (ИА) в рамках катетерной аблации (КА) желудочковых тахикардий (ЖТ) без применения флюороскопии у пациентов с хронической сердечной недостаточностью
Материал и методы исследования. В проспективном исследовании 47 пациентам с ишемической болезнью сердца, хронической сердечной недостаточностью была выполнена КА устойчивых ЖТ. Оценивались интраоперационные параметры КА, в том числе величина среднего индекса аблации. Оценивался факт индукции аритмии после серии радиочастотных (РЧ) воздействий. Также проводилась оценка рецидива ЖТ. Срок наблюдения составил 12 месяцев.
Результаты. Во время оперативного вмешательства после нанесения РЧ-воздействий индукция аритмии была неосуществима у 100% пациентов. Спустя 12 месяцев наблюдения свобода от аритмии составила 84,8%. Пациенты без рецидива ЖТ имели статистически значимо больший показатель среднего ИА (612 [522,5;683,5]), чем с рецидивом ЖТ (7 (15,2%) пациентов) (438 [416,5;462]) (p=0,001). Также проводилась оценка возможности прогнозирования рецидива ЖТ в зависимости от величины среднего ИА. Было получено, что при величине среднего ИА больше или равном 473, риск рецидива ЖТ ниже (р=0,001).
Заключение. ИА может быть использован в качестве параметра контроля эффективного РЧ-воздействия в рамках проведения КА ЖТ наряду с другими детерминантами, используемыми в настоящее время.
Цель. Оценить прогностическое значение локальных захватов (ЛЗ) после изоляции устьев легочных вен (ЛВ) у пациентов с непароксизмальной формой фибрилляции предсердий (ФП) на отдаленные результаты радиочастотной аблации (РЧА).
Материал и методы исследования. Исследование одноцентровое обсервационное проспективное. Общее количество пациентов 110. Всем выполнена первичная катетерная аблация по поводу непароксизмальной формы ФП. Во время операции оценивалась активность ЛВ и наличие ЛЗ. Пациенты, у которых ЛЗ после изоляции ЛВ встречались хотя бы в одной ЛВ, вошли в первую группу; больные, у которых ЛЗ отсутствовали - во вторую. Первая группа - 54 пациента, вторая группа - 56 пациентов. Группы больных не имели статистически значимых различий по основным показателям - полу, весу, возрасту, длительности анамнеза, объему левого предсердия и фракции выброса левого желудочка, а также по сопутствующей патологии. Характеристики проведенных операций - время РЧА и флюороскопии, длительность - между группами так же не имели статистически значимых различий.
Результаты. Период наблюдения за больными составил в среднем 800 [286,5;800] дней. Среди всей когорты пациентов общая эффективность лечения составила 68,2% (75 пациентов из 110) с учетом повторных операций. В группе с ЛЗ синусовый ритм по истечении срока наблюдения сохранялся у 42 пациентов из 54 (77,7%), в группе без ЛЗ у 33 пациентов из 56 (58,9%). Различие является статистически значимым (отношение шансов 2,439 (95% доверительный интервал 1,060–5,615 p=0,034). Наличие ЛЗ при построении многофакторной логистической регрессионной модели является предиктором эффективности РЧА (χ2=14,710; р=0,012).
Заключение. В данном исследовании ЛЗ в ЛВ у пациентов с непароксизмальной формой ФП после выполнения катетерной изоляции ЛВ являлись предиктором улучшения отдаленных результатов радиочастотной аблации.
Цель. Разработать прогностическую модель и балльную шкалу вероятности развития кардиомиопатии (КАА), ассоциированной с идиопатическими желудочковыми аритмиями (ЖА) у детей.
Материал и методы исследования. В исследование было включено 492 ребенка в возрасте от 1 до 17 лет с идиопатическими ЖА. Для создания прогностической модели была сформирована обучающая выборка (n=392), для валидации - тестовая выборка (n=100). Поиск независимых предикторов осуществлялся методом бинарной логистической регрессии, баллы для каждого предиктора устанавливались на основании показателя оценки шансов.
Результаты. Было установлено, что площадь поверхности тела ≥ 1,7 м2 увеличивает шансы развития КАА в 4,9 раза (1 балл), длительность предэктопического интервала желудочковой экстрасистолы < 434 мс - в 3,7 раза (1 балл), плотность ЖА 25-29% - в 8,4 раза (2 балла), плотность ЖА 30-34% - в 11,3 раза (3 балла), плотность ЖА ≥35% - в 17,2 раза (4 балла). Методом ROC анализа была определена специфичность суммы баллов. При сумме баллов до 2 определялась низкая вероятность (специфичность <48,1%), при сумме баллов 3-4 - средняя вероятность (специфичность 67,5-81,8%), при сумме баллов 5-6 - высокая вероятность развития КАА (специфичность >95,1%). AUC шкалы прогноза развития КАА составила 0,805±0,037 (95% ДИ: 0,732-0,878), p<0,001. AUC шкалы прогноза развития КАА у тестовой группы составила 0,893±0,034 (95% ДИ: 0,827-0,96), p<0,001. Разность площади ROC-кривой суммы баллов обучающей и тестовой групп составила 0,088±0,05. Площади под ROC-кривыми были сопоставимы (p=0,078).
Заключение. В ходе исследования были выявлены независимые предикторы развития КАА у детей с идиопатическими ЖА. На основании полученных предикторов была разработана шкала вероятности развития КАА, использование которой позволит рутинно оценивать вероятность развития КАА и сформировать персонализированный подход к наблюдению и лечению каждого ребенка с идиопатическими ЖА.
Цель. Оценка влияния сопутствующих заболеваний и аритмического анамнеза на вольтажные характеристики левого предсердия у пациентов с персистирующей фибрилляцией предсердий (ФП).
Материал и методы исследования. В исследование было включено 50 пациентов с персистирующей ФП, направленных на первичную радиочастотную аблацию. Всем пациентам выполнялось вольтажное картирование левого предсердия. Вольтажные карты состояли как минимум из 2000 точек, среднее количество точек 2128±104. Области с амплитудой биполярного сигнала 0,1-0,5 мВ относили к области низкого вольтажа (НВ), области с амплитудой биполярного сигнала менее 0,1 мВ расценивали, как область очень низкого вольтажа. Для каждой карты был рассчитан НВ% и процент очень низкого вольтажа.
Результаты. Мы выявили статистически значимую заметную корреляцию НВ% с возрастом (p<0,001 r=0,720), женским полом (p=0,016) и длительностью анамнеза на момент старта персистирования (p<0,001, r=0,503). На основании полученных нами данных для прогнозирования НВ% была разработана оригинальная шкала. Шкала включает: возраст, женский пол, длительность аритмического анамнеза на момент старта персистирования. При возрасте более 65 лет присваивался 1 балл, пациентам женского пола присваивался 1 балл, при длительности аритмического анамнеза на момент старта персистирования более 4 месяцев 1 балл, в остальных случаях 0 баллов. Количество баллов по данной шкале показало высокую корреляцию с НВ% (p<0,001 r=0,768). Шкала получила название ВЖД-ритм (Возраст, Женский пол, Длительность анамнеза на момент старта персистирования).
Заключение. Возраст, женский пол, и длительность аритмического анамнеза на момент старта персистирования являются предикторами процента сниженного вольтажа левого предсердия у пациентов с персистирующей ФП. Предложенная оригинальная шкала ВЖД-ритм может использоваться для прогнозирования объема сниженного вольтажа у пациентов с персистирующей ФП.
Издательство
- Издательство
- ТД ИНКАРТ
- Регион
- Россия, Санкт-Петербург
- Почтовый адрес
- Россия, 194214, Санкт-Петербург, Выборгское шоссе, д. 22А
- Юр. адрес
- 190068, г Санкт-Петербург, Адмиралтейский р-н, пер Бойцова, д 4, помещ 3Н офис 1
- ФИО
- Катковник Илья Владимирович (ГЕНЕРАЛЬНЫЙ ДИРЕКТОР)
- Контактный телефон
- +7 (___) _______