ВВЕДЕНИЕ. Информация, предназначенная для пациента и включаемая в листок-вкладыш к лекарственному препарату, должна обеспечивать возможность эффективного и безопасного применения препарата за счет соответствующих разъяснений, однако объем необходимых разъяснений и необходимость введения определений для каждого из используемых терминов не ясны.
ЦЕЛЬ. Оценка понимания случайных медицинских терминов из утвержденных инструкций по медицинскому применению лекарственных препаратов, зарегистрированных в Российской Федерации, респондентами, не имеющими медицинского образования, которые могут потенциально соответствовать целевой популяции пациентов; статистическая оценка связи демографических характеристик популяции с результатами тестирования.
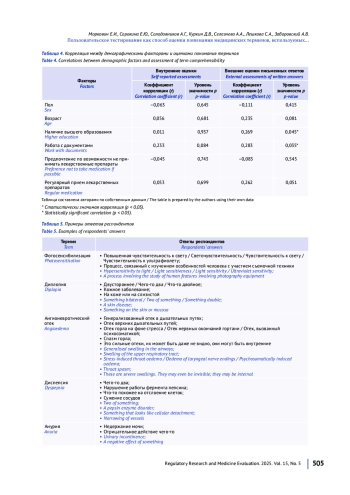
МАТЕРИАЛЫ И МЕТОДЫ. Тестирование проводили на платформе Google Forms. Из глоссария были выбраны 11 случайных терминов, использовавшихся в утвержденных инструкциях по медицинскому применению лекарственных препаратов, зарегистрированных в России. Статистический анализ понятности проводили для 63 респондентов, о которых были собраны демографические данные, включающие возраст и уровень образования.
РЕЗУЛЬТАТЫ. Для некоторых медицинских терминов было выявлено завышение внутренней оценки понятности: респонденты считали термин понятным, но давали ему неверное определение. Всем протестированным терминам респонденты давали верное определение менее чем в 80% случаев; наиболее понятными терминами оказались «ринит» (66,1% оценщиков), «ангионевротический отек» (28,6%), «экзантема» (25,0%) и «анурия» (25,0%). Лица с высшим образованием, а также те, кто работает с документами, чаще давали правильное определение термину.
ВЫВОДЫ. При разработке листков-вкладышей, содержащих любые медицинские термины, независимо от того, насколько частым является их употребление за пределами медицинских учреждений, важно учитывать неоднородность характеристик целевой аудитории, обусловленную в числе прочего различиями в уровне образования. Термины, которые вызывают наибольшие трудности в понимании при пользовательском тестировании, должны быть дополнительно пояснены или заменены на более понятные синонимы.
Идентификаторы и классификаторы
- SCI
- Здравоохранение
Потребность в разработке инструкции по медицинскому применению (ИМП) лекарственного препарата в форме листка-вкладыша (ЛВ), предназначенного непосредственно для пациента, обсуждалась за рубежом с конца 1960-х гг. [1], однако обязательными документы такого типа стали лишь в конце 1990-х гг. со вступлением в силу соответствующей директивы Совета Европейского союза1.
Список литературы
1. Tong V, Aslani P, Raynor DK, Shipp D, Parkinson B, Lalor D, et al. Developing and user testing new pharmacy label formats - a study to inform labelling standards. Health Expect. 2021;24(4):1125-36. DOI: 10.1111/hex.13203
2. Ancker JS, Grossman LV, Benda NC. Health literacy 2030: Is it time to redefine the term? J Gen Intern Med. 2020;35(8):2427-30. DOI: 10.1007/s11606-019-05472-y
3. Dickinson D, Raynor DK, Duman M. Patient information leaflets for medicines: Using consumer testing to determine the most effective design. Patient Educ Couns. 2001;43(2):147-59. DOI: 10.1016/s0738-3991(00)00156-7
4. Sless D. Designing documents for people to use. Melbourne: Communication Research Institute; 1996.
5. Fuchs J. Design science with a focus on user-centred evaluation of written information. In: Bahri P, ed. Communicating about risks and safe use of medicines. Adis Singapore; 2020. DOI: 10.1007/978-981-15-3013-5_12
6. Okan Y, Petrova D, Smith SG, Lesic V, Bruine de Bruin W. How do women interpret the NHS information leaflet about cervical cancer screening? Med Decis Making. 2019;39(7):738-54. DOI: 10.1177/0272989X19873647
7. Munksgaard SB, Allena M, Tassorelli C, Rossi P, Katsarava Z, Bendtsen L, et al. What do the patients with medication overuse headache expect from treatment and what are the preferred sources of information? J Headache Pain. 2011;12(1):91-6. DOI: 10.1007/s10194-011-0298-4
8. Tong V, Raynor DK, Aslani P. Design and comprehensibility of over-the-counter product labels and leaflets: A narrative review. Int J Clin Pharm. 2014;36(5):865-72. DOI: 10.1007/s11096-014-9975-0
9. Pelizzari N. The challenges for EU user testing policies for patient information leaflets. Int J Environ Res Public Health. 2024;21(10):1301.
Выпуск
Другие статьи выпуска
ВВЕДЕНИЕ. Гречиха красностебельная (Fagopyrum rubricaulis, сем. Polygonаceae) отличается высоким содержанием флавоноидов, в первую очередь рутина, а в надземной части — кверцетина, изокверцетина, ориентина, витексина, изоориентина, изовитексина и других соединений. Известные фармакологические эффекты гречихи красностебельной — антиоксидантное, кардиопротекторное, гипогликемическое, антибактериальное действие — зависят от комплекса содержания флавоноидов в растительном сырье, поэтому траву гречихи целесообразно стандартизировать по сумме флавоноидов. Однако в отечественной литературе недостаточно информации по стандартизации сырья гречихи красностебельной, в связи с чем разработка методики количественного определения флавоноидов является актуальной.
ЦЕЛЬ. Разработка и валидация методики количественного определения флавоноидов в траве гречихи красностебельной с использованием спектрофотометрии.
МАТЕРИАЛЫ И МЕТОДЫ. Объектом исследования являлась трава гречихи красностебельной. В процессе извлечения были использованы различные экстрагенты (вода очищенная и спирт этиловый 40, 70 и 95%). Подтверждение наличия флавоноидов в сырье проводили методом тонкослойной хроматографии. Для количественного определения флавоноидов в траве гречихи красностебельной был использован спектрофотометрический метод, основанный на измерении оптической плотности раствора в присутствии алюминия хлорида. Валидацию методики проводили согласно Государственной фармакопее Российской Федерации XV издания.
РЕЗУЛЬТАТЫ. Согласно результатам идентификации методом тонкослойной хроматографии водно-спиртовые извлечения травы гречихи содержали флавоноиды. Способ количественного определения суммы флавоноидов в сырье гречихи красностебельной методом дифференциальной спектрофотометрии предполагает предварительное получение водно-спиртового извлечения путем однократной экстракции точной навески 1 г травы гречихи, измельченной до размера частиц не более 2 мм, спиртом этиловым 40% в соотношении сырье: экстрагент 1:25 при продолжительности экстракции 30 мин. Максимумы поглощения комплексов экстрактов с растворами алюминия хлорида наблюдались при длине волны 410 нм, что соответствовало максимуму поглощения раствора стандартного образца рутина. Количественное определение суммы флавоноидов проводили в пересчете на рутин. Получены результаты валидации методики по критериям: специфичность, линейность, повторяемость, внутрилабораторная воспроизводимость. С помощью разработанной методики были проанализированы четыре образца травы гречихи красностебельной производства ООО «Парафарм». Содержание суммы флавоноидов в пересчете на рутин варьировало от 9,15±0,20 до 9,55±0,11%.
ВЫВОДЫ. Разработана и валидирована спектрофотометрическая методика количественного определения суммы флавоноидов в пересчете на рутин в траве гречихи красностебельной. Данная методика может быть использована для стандартизации лекарственного сырья гречихи красностебельной.
ВВЕДЕНИЕ. Биомаркеры используют при оценке нормальных физиологических процессов в организме; для диагностики и подбора терапии различных заболеваний; при разработке новых лекарственных препаратов. Расширение использования биомаркеров в качестве инструментов разработки лекарственных препаратов обусловливает необходимость совершенствования методов их количественного определения.
ЦЕЛЬ. Обобщение материалов по вопросам валидации биоаналитических методик количественного определения биомаркеров.
ОБСУЖДЕНИЕ. Использованы регуляторные документы Международного совета по гармонизации (International Council for Harmonisation, ICH), Управления по контролю за качеством продуктов питания и лекарственных средств (Food and Drug Administration, FDA), включая Рабочую группу по совместному обсуждению анализа биомаркеров (Biomarker Assay Collaborative Evidentiary Considerations Writing Group) и Институт критического пути (Critical Path Institute, C-Path) Европейского агентства по лекарственным средствам (European Medicines Agency, EMA), Евразийской экономической комиссии (ЕЭК) и научные публикации, находящиеся в открытом доступе (в том числе по данным библиографических баз и поисковых систем PubMed, Web of Science, РИНЦ (eLIBRARY. RU), Google Scholar), преимущественно опубликованные в период 2014–2024 гг. Рассмотрены процессы аналитической и клинической валидации биомаркеров, отмечены этапы их аналитической валидации, выделены ключевые показатели валидации биоаналитической методики в зависимости от задачи (анализ для исследований фармакокинетики, биоэквивалентности и токсикокинетики; анализ биомаркеров при разработке лекарственных препаратов и для диагностики в ходе доклинических и клинических исследований). Предложен алгоритм выбора уровня аналитической валидации биомаркеров в зависимости от особенностей метода (хроматография, лигандсвязывающие методы с использованием наборов реагентов различного назначения) и решаемых задач.
ВЫВОДЫ. Подтверждение пригодности методики анализа биомаркеров для применения согласно планируемым целям близко к общепринятой процедуре валидации биоаналитических методик. Необходимо широкое научное обсуждение деталей валидации анализа биомаркеров, поскольку выработка единого алгоритма этой сложной процедуры будет способствовать более надежному использованию биомаркеров, повышению качества сопутствующих этому процессу исследований и конечному результату — введению в обращение новых эффективных и безопасных лекарственных препаратов.
ВВЕДЕНИЕ. Значимым направлением развития фармацевтической промышленности является переработка местного лекарственного растительного сырья. Одним из источников такого сырья может служить золотарник канадский (Solidago canadensis L.), обладающий противовоспалительными и диуретическими свойствами и произрастающий на территориях Российской Федерации и Беларуси. Предварительная обработка лекарственного растительного сырья повышает выход биологически активных веществ (в частности, флавоноидов) при экстракции, что целесообразно использовать при получении настойки и экстрактов золотарника канадского травы.
ЦЕЛЬ. Разработка технологии получения экстракционных лекарственных форм (настойка, экстракт) из золотарника канадского травы с использованием этапа предварительной обработки, позволяющего увеличить содержание флавоноидов.
МАТЕРИАЛЫ И МЕТОДЫ. Объект исследования — золотарника канадского трава. Изучали четыре способа предварительной обработки сырья: термообработка, обезжиривание и их комбинации в двух вариантах. Содержание флавоноидов определяли методом высокоэффективной жидкостной хроматографии. Содержание остаточных количеств органических растворителей — методом газовой хроматографии.
РЕЗУЛЬТАТЫ. Наибольший выход флавоноидов в настойки наблюдали при объемной доле этанола — 60%, соотношении сырье (г): экстрагент (мл) — 1:25, степени измельчения сырья — 2000 мкм, времени отстаивания первичной вытяжки — не более 4 сут при получении методом ремацерации. Наибольшее содержание флавоноидов в сухих экстрактах отмечено при относительном объеме отгонки 90%, температуре отгонки 80 °С, минимальном времени отгонки 40 мин, отгоняемом объеме 6 мл, времени отстаивания первичной вытяжки не более 4 сут. Наибольший выход флавоноидов в настойку наблюдался при термообработке золотарника канадского травы, в сухой экстракт — при предварительном обезжиривании лекарственного растительного сырья.
ВЫВОДЫ. Установлены оптимальные технологические параметры получения настоек и экстрактов золотарника канадского травы. Технологии получения настоек и сухих экстрактов, разработанные с учетом этапа предобработки, могут быть использованы для получения указанных экстракционных лекарственных форм золотарника канадского травы, обогащенных флавоноидами.
ВВЕДЕНИЕ. Этилтиобензимидазола фумарат (ЭТБИФ) — актопротекторная и адаптогенная активная фармацевтическая субстанция. Установлено, что эффективность терапии ЭТБИФ достигается при курсовом введении с высокой частотой приема, также отмечены нежелательные действия, связанные с растворением ЭТБИФ в среде желудка. В связи с этим актуальной является разработка матричной лекарственной формы с профилем высвобождения, который позволит нивелировать описанный побочный эффект, снизить частоту приема и тем самым повысить комплаентность к терапии. ЦЕЛЬ. Разработка состава и технологии матричных таблеток этилтиобензимидазола фумарата в соответствии с заданным профилем высвобождения (полное высвобождение в течение 12 ч, не более 50% ЭТБИФ высвобождается в кислой среде в течение первых 2 ч, оставшееся количество равномерно высвобождается за последующие 10 ч в среде, моделирующей условия кишечника).
МАТЕРИАЛЫ И МЕТОДЫ. Объектом исследования является субстанция этилтиобензимидазола фумарата, а также матричные таблетки с гидроксипропилметилцеллюлозой и этилцеллюлозой на ее основе. Изучены механические свойства таблеток, определены показатели «прочность на раздавливание» и «истираемость». Изучение профилей высвобождения ЭТБИФ проводили в фосфатных буферных средах (pH 1,2; 4,5 и 6,8) с использованием тестера растворения и УФ-спектрометрии.
РЕЗУЛЬТАТЫ. Изучена кинетика высвобождения ЭТБИФ из матричных систем, содержащих матрицеобразующие агенты с разными принципами образования матрицы. Для составов на основе гидроксипропилметилцеллюлозы удалось достичь пролонгированного высвобождения субстанции ЭТБИФ с 90%-ным высвобождением активной фармацевтической субстанции из таблеток через 12 ч. Для составов с этилцеллюлозой высвобождение субстанции составило от 60 до 90%, при этом в кислой среде высвобождается большая часть ЭТБИФ. Установлено, что введение кислотного агента не влияет на профиль высвобождения ЭТБИФ из матричных таблеток.
ВЫВОДЫ. В ходе исследования разработан состав матричных таблеток, удовлетворяющий заданному профилю высвобождения. Наиболее полное и равномерное высвобождение субстанции в среде, моделирующей условия желудочно-кишечного тракта, достигнуто из матричных таблеток на основе гидроксипропилметилцеллюлозы. Показано, что введение кислотного агента не оказывает влияния на высвобождение ЭТБИФ, несмотря на повышенную растворимость субстанции в кислой среде.
ВВЕДЕНИЕ. В подготовке к диагностическим процедурам и хирургическим вмешательствам на толстом кишечнике важную роль играет очищение кишечника. Одним из основных факторов, обеспечивающих качественное очищение кишечника, является правильный выбор лекарственного препарата (ЛП), оказывающего воздействие на кишечное содержимое и удаляющего его из организма. Актуальной является разработка новых эффективных ЛП для очищения кишечника, характеризующихся хорошей переносимостью и благоприятным профилем безопасности. Рекомендации по планированию программы клинических исследований (КИ) ЛП для очищения кишечника в настоящее время в Российской Федерации и в других странах ЕАЭС отсутствуют.
ЦЕЛЬ. Подготовка рекомендаций по планированию программы клинических исследований лекарственных препаратов для очищения кишечника.
ОБСУЖДЕНИЕ. Проведен анализ основных положений руководства Европейского агентства по лекарственным средствам (EMA) по проведению КИ новых ЛП для очищения кишечника; даны рекомендации по проведению фармакологических исследований и подтверждающих КИ (дизайн, популяция исследования, критерии оценки эффективности и безопасности), а также проведению КИ у детей и пациентов пожилого возраста. Особенности КИ ЛП для очищения кишечника: в исследование включают пациентов с заболеванием кишечника, не имеющих иных заболеваний; дизайн подтверждающих КИ III фазы — рандомизированные, с активным контролем, в параллельных группах; необходима оценка безопасности при однократном применении ЛП, долгосрочные исследования безопасности не требуются.
ВЫВОДЫ. Основные методологические подходы, изложенные в Руководстве ЕМА по проведению КИ ЛП для очищения кишечника, позволяют оценить эффективность и безопасность указанных ЛП и могут быть взяты за основу при подготовке рекомендаций к планированию программы КИ ЛП препаратов для очищения кишечника.
ВВЕДЕНИЕ. Новый селективный ингибитор карбоангидразы II типа 5-[5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамид (TFISA) способен снижать внутриглазное давление при инстилляции в глаза. Данное соединение находится на стадии доклинического исследования. Процесс экскреции TFISA и его метаболитов ранее не изучен. ЦЕЛЬ. Определение параметров экскреции 5-[5-(трифторметил)-1,2-оксазол-3- ил]-фуран-2-сульфонамида и его основных метаболитов у крыс.
МАТЕРИА ЛЫ И МЕТОДЫ. Работа выполнена на 6 крысах линии Wistar (3 самца и 3 самки). Введение осуществляли путем инстилляции 1% глазной суспензии TFISA в каждый глаз из расчета 3,7 мг/кг. Пробы фекалий и мочи отбирали до введения препарата и многократно до 360 ч после введения. Отбор экскретов проводили с помощью метаболических клеток. Измерение концентрации TFISA, N-ацетил-5-[5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамида (М2), N-гидрокси-5-[5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамида (M1) и продукта его деградации 5-[5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2- сульфоновой кислоты (M3) в экскретах проводили методом высокоэффективной жидкостной хроматографии с тандемным масс-спектрометрическим детектированием.
РЕЗУЛЬТАТЫ. Биоаналитические методики определения TFISA и его метаболитов в экскретах крыс прошли полную валидацию. Аналитический диапазон определения TFISA, М2 и М3 в моче составил 10–10000 нг/мл, M1 — 1–1000 нг/мл. Аналитический диапазон определения концентрации TFISA в фекалиях составил 10–4000 нг/г, М2 и М3 — 5–2000 нг/г, М1 — 1–1000 нг/г. Установлено, что с мочой выводится 45,7±2,0% TFISA в неизменном виде, 38,7±2,7% в виде М1 и продукта его разложения М3, и 4,0±0,6% в виде М2 от общего количества элиминированных соединений. С калом выводится 8,2±1,0% TFISA в неизменном виде, 3,3±0,2% в виде продукта разложения N-гидроксиметаболита М3. Через 336 ч после введения TFISA дальнейшей элиминации не наблюдали.
ВЫВОД. С помощью разработанных и валидированных биоаналитических методик изучена экскреция TFISA и его метаболитов после аппликации глазной суспензии крысам в одной дозе. TFISA выводится преимущественно ренальным путем в неизменном виде, а также в виде N-гидроксиметаболита, который в процессе отбора образцов практически полностью разлагается до производного сульфокислоты. N-ацетилметаболит является минорным и выводится только с мочой.
Государственная фармакопея является стратегическим документом, определяющим стандарты качества и безопасности лекарственных средств в России. Ее современное развитие неразрывно связано с деятельностью ФГБУ «НЦЭСМП» Минздрава России. В эксклюзивном интервью директор Института фармакопеи и стандартизации в сфере обращения лекарственных средств, доктор фарм. наук, профессор Валерия Леонидовна Багирова рассказывает о ключевых вехах этого пути. Особое внимание в беседе уделяется гармонизации российских требований с нормами Фармакопеи ЕАЭС и ведущих мировых фармакопей. Активная международная кооперация и более 45% новых статей в XV издании российской фармакопеи демонстрируют динамичное развитие фармакопеи. Это интервью наглядно показывает, как формируется единое фармакопейное пространство для обеспечения пациентов качественными и безопасными лекарственными препаратами.
Издательство
- Издательство
- НЦЭСМП
- Регион
- Россия, Москва
- Почтовый адрес
- 127051, г. Москва, Петровский бульвар, д. 8, стр. 2
- Юр. адрес
- 127051, г. Москва, Петровский бульвар, д. 8, стр. 2
- ФИО
- Косенко Валентина Владимировна (ИСПОЛНЯЮЩИЙ ОБЯЗАННОСТИ ГЕНЕРАЛЬНОГО ДИРЕКТОРА)
- E-mail адрес
- general@expmed.ru
- Контактный телефон
- +7 (499) 1901818